酿酒酵母转录因子Cdc73 C-terminal 的结构
Paf1复合物(Paf1C)是一种在真核生物中非常保守的复合物,目前已获得鉴定的Paf1C中,含有Paf1、Cdc73、Ctr9,Leo1及Rtf1 (最近发现hSki8也是其人源复合物的组分之一)五种蛋白组分。Paf1C主要功能是通过与RNA聚合酶II(RNA polⅡ)相互作用,共同参与包括转录起始、延伸和终止的全过程。目前对该复合物及其蛋白质亚基的结构报道很少,在酿酒酵母Cdc73的C-terminal domain结构被报道之前,仅有人源Rtf1的Plus-3 domain被报道。中国科学技术大学滕脉坤教授及牛立文教授研究组利用北京同步辐射装置3W1A-生物大分子实验站,在线站相关工作人员的帮助下收集到了2.5Å分辨率的酿酒酵母Cdc73的C-terminal domain衍射数据,利用重原子碘的反常散射数据,解析了其晶体结构。相关的研究结果于2012年8月发表在 《Acta Crystallographica Section D Biological Crystallography》杂志上。同时期匹兹堡大学的Karen M. Arndt,Andrew P. VanDemark实验组也解析了该区段结构。
Paf1复合物作为一个平台,通过与各种转录因子的相互作用并把这些转录因子招募到RNA polⅡ上共同参与转录。最新研究表明Cdc73, Rtf1, Ctr9都可以与磷酸化的RNA polⅡ的C端结构域相互作用,Cdc73的C-terminal结构直接参与了相互作用。
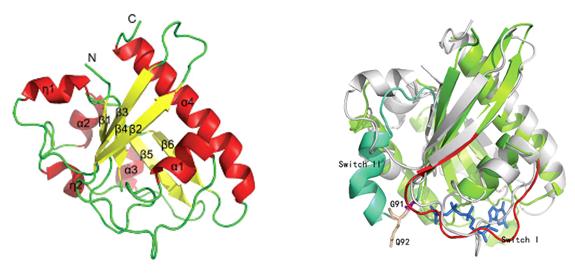
图1Cdc73 C-terminal 卡通结构图 图2Cdc73与Rab33B结构比对图
研究表明人源的Cdc73是一个肿瘤抑制因子,它的突变可导致甲状旁腺功能亢进症-颌骨肿瘤综合征(HPT-JT)以及其他一些肿瘤。Cdc73的羧基端序列非常保守,其结构是一个由中心6个β折叠片被6个α螺旋包裹的α/β结构,通过Dali在线比对发现其与经典的GTPase的结构非常类似。但序列分析显示Cdc73与GTPase的同源度非常低,且关键区域也不保守。通过等温滴定量热法检测不到Cdc73与GTP明显结合,也不具有水解GTP的GTPase酶活性,因此Cdc73尽管与GTPase具有类似的折叠方式,但可能不是一个与GTPase。该结构的解析为加深人们对Paf1复合物组装的认识提供了重要思路,为Cdc73与RNA PolⅡ相互作用的研究以及人源的Cdc73与疾病相关研究等提供了重要的结构基础。进一步的工作正在进行中。发表文章:
Hongkai Chen, Nuo Shi,Yongxiang Gao, Xu Li, Maikun Teng* and Liwen Niu*, Crystallographic analysis of the conserved C-terminal domain of transcription factor Cdc73 from Saccharomyces cerevisiae reveals a GTPase-like fold. Acta Crystallogr D Biol Crystallogr. 68(Pt 8):953-9, 2012.
